重磅:Merck公司向FDA提交新冠口服药Molnupiravir的授权申请
世卫组织网站最新数据显示,截至北京时间2021年10月11日23时52分,全球确诊病例较前一日增加236629例,累计确诊达237383711例;死亡病例增加3302例,达到4842716例。
2021年10月11日,默沙东(Merck)和Ridgeback Biotherapeutics公司宣布向FDA提交一项紧急使用授权(EUA)申请——口服抗病毒药物molnupiravir,用于治疗轻至中度新冠肺炎(有进展为重症的风险或有住院风险)的成人患者。两家公司正积极与世界各地的监管机构合作,且将在未来几个月内提交紧急使用或销售授权申请。
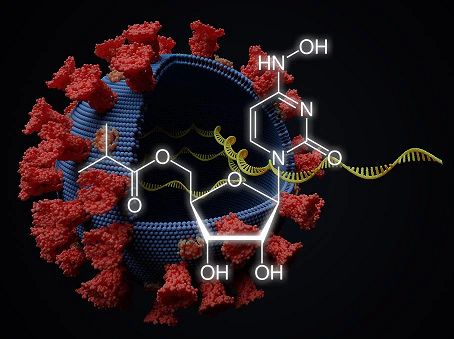
该提交是基于3期MOVe-OUT临床试验计划的中期分析的积极结果,该试验评估了molnupiravir在轻至中度新冠肺炎(有进展为重症的风险或有住院风险)的成人患者中的疗效。在中期分析中,molnupiravir降低了约50%的住院或死亡风险,7.3%接受molnupiravir的患者在随机分组后的第29天住院或死亡,而安慰剂治疗的患者有14.1%。在第29天时,在接受molnupiravir的患者中没有死亡报告,而在接受安慰剂的患者中,有8人死亡。在molnupiravir和安慰剂组中,发生任何级别不良事件分别为35%和40%。药物相关不良事件的分别为12%和11%,与安慰剂组(3.4%)相比,molnupiravir组(1.3%)因不良事件而停止治疗的受试者较少。
Merck公司的首席执行官兼总裁Robert M. Davi表示:“这次疫情的巨大影响要求我们迅速采取行动,在收到数据的10天内,我们向FDA提交了molnupiravir的EUA申请。我很感激在此次试验中,所有受试者及研究人员的付出。借此机会,我要向我们团队以及全球卫生领域的合作伙伴致敬,感谢大家勇于接受抗击新冠病毒的挑战。”
让我们期待molnupiravir的获批,尽快为全球更多患者带来希望和帮助。
免责声明:《重磅:Merck公司向FDA提交新冠口服药Molnupiravir的授权申请》由海鸥药房编辑整理,如有侵权请及时联系。另外文章中所提到的药品用法用量及疾病建议等相关资讯仅供医护人员参考,不可作任何用药依据!
 haioushop04
haioushop04